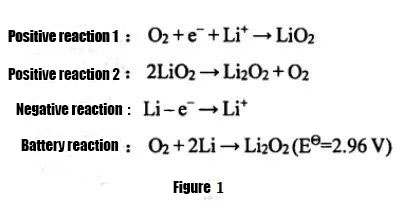01 리튬공기전지와 리튬황전지란?
① 리튬-공기 배터리
리튬-공기 배터리는 양극 반응물로 산소를 사용하고 음극으로 금속 리튬을 사용합니다.이론적 에너지 밀도(3500wh/kg)가 높고 실제 에너지 밀도는 500-1000wh/kg에 도달할 수 있으며 이는 기존 리튬 이온 배터리 시스템보다 훨씬 높습니다.리튬 공기 전지는 양극, 전해질 및 음극으로 구성됩니다.비수계 배터리 시스템에서는 현재 순수한 산소가 반응 가스로 사용되므로 리튬-공기 배터리는 리튬-산소 배터리라고도 할 수 있습니다.
1996년에 Abraham et al.실험실에서 최초의 비수성 리튬-공기 전지를 성공적으로 조립했습니다.그런 다음 연구원들은 비수성 리튬-공기 전지의 내부 전기화학 반응과 메커니즘에 주목하기 시작했습니다.2002년, Read et al.리튬-공기 배터리의 전기화학적 성능이 전해질 용매와 공기 음극 물질에 의존한다는 것을 발견했습니다.2006년, Ogasawara et al.질량분석기를 이용하여 충전 중 Li2O2가 산화되고 산소가 방출됨을 처음으로 증명하여 Li2O2의 전기화학적 가역성을 확인하였다.따라서 리튬-공기 전지는 많은 관심과 급속한 발전을 받아왔다.
② 리튬-황 배터리
리튬-황 전지는 고용량 유황(1675mAh/g)과 리튬금속(3860mAh/g)의 가역반응을 기반으로 한 이차전지 시스템으로 평균 방전전압은 약 2.15V이다.이론적 에너지 밀도는 2600wh/kg에 도달할 수 있습니다.그 원료는 저원가와 환경 친화성이라는 장점이 있어 발전 잠재력이 크다.리튬-황 배터리의 발명은 Herbert와 Ulam이 배터리 특허를 신청한 1960년대로 거슬러 올라갑니다.이 리튬-황 배터리의 프로토타입은 리튬 또는 리튬 합금을 음극 물질로, 황을 양극 물질로 사용했으며 지방족 포화 아민으로 구성되었습니다.전해질.몇 년 후 PC, DMSO, DMF 등의 유기용제를 도입하여 리튬황 전지를 개량하여 2.35~2.5V 전지를 얻었다.1980년대 후반에 에테르는 리튬-황 배터리에 유용하다는 것이 입증되었습니다.후속 연구에서 에테르 기반 전해질의 발견, 전해질 첨가제로 LiNO3 사용, 탄소/황 복합 양극의 제안으로 리튬-황 배터리 연구 붐이 일어났습니다.
02 리튬공기전지와 리튬황전지의 작동원리
① 리튬-공기 배터리
사용되는 전해질의 다른 상태에 따라 리튬-공기 배터리는 수성 시스템, 유기 시스템, 물-유기 하이브리드 시스템 및 전고체 리튬-공기 배터리로 나눌 수 있습니다.그 중 수계전해질을 사용하는 리튬공기전지의 낮은 비용량, 리튬금속 보호의 어려움, 계의 가역성 불량 등으로 인해 비수계 유기 리튬공기전지와 전고체 리튬공기전지는 배터리는 현재 더 널리 사용됩니다.연구.비수성 리튬-공기 배터리는 1996년 Abraham과 Z.Jiang에 의해 처음 제안되었습니다. 방전 반응 방정식은 그림 1에 나와 있습니다. 충전 반응은 반대입니다.전해질은 주로 유기 전해질 또는 고체 전해질을 사용하며 방전 생성물은 주로 Li2O2이며 생성물은 전해질에 불용성이며 공기 양극에 쉽게 축적되어 리튬 공기 전지의 방전 용량에 영향을 미칩니다.
리튬-공기 전지는 초고에너지 밀도, 친환경성, 저렴한 가격 등의 장점을 가지고 있으나 아직 연구 초기 단계로 산소 환원 반응의 촉매 작용, 공기 전극의 산소 투과성 및 소수성, 공기 전극의 비활성화 등
② 리튬-황 배터리
리튬-황 전지는 전지의 양극 재료로 원소 황 또는 황계 화합물을 주로 사용하고, 음극에는 금속 리튬을 주로 사용한다.방전 과정에서 음극에 위치한 금속 리튬은 산화되어 전자를 잃고 리튬 이온을 생성합니다.그 후 전자는 외부 회로를 통해 양극으로 전달되고, 생성된 리튬 이온도 전해질을 통해 양극으로 전달되어 황과 반응하여 폴리설파이드를 형성한다.리튬(LiPSs), 그리고 추가로 반응하여 황화리튬을 생성하여 방전 과정을 완료합니다.충전 과정에서 LiPS의 리튬 이온은 전해질을 통해 음극으로 돌아가고 전자는 외부 회로를 통해 음극으로 돌아가 리튬 이온과 함께 리튬 금속을 형성하고 LiPS는 양극에서 황으로 환원되어 충전을 완료한다. 충전 과정.
리튬-황 배터리의 방전 과정은 주로 황 음극에서 다단계, 다전자, 다상 복합 전기화학 반응이며, 서로 다른 사슬 길이를 가진 LiPS는 충방전 과정에서 서로 변환됩니다.방전 과정에서 양극에서 일어날 수 있는 반응을 Figure 2에, 음극에서 일어날 수 있는 반응을 Figure 3에 나타내었다.
리튬-황 배터리의 장점은 매우 높은 이론적 용량과 같이 매우 명백합니다.재료에 산소가 없으며 산소 발생 반응이 발생하지 않으므로 안전 성능이 좋습니다.유황 자원은 풍부하고 원소 유황은 저렴합니다.환경 친화적이며 독성이 낮습니다.그러나 리튬-황 배터리에는 리튬 폴리설파이드 셔틀 효과와 같은 몇 가지 어려운 문제가 있습니다.원소 황 및 그 배출 생성물의 절연;큰 볼륨 변화의 문제;리튬 양극으로 인한 불안정한 SEI 및 안전 문제;자기방전 현상 등
차세대 이차전지 시스템인 리튬-공기 전지와 리튬-황 전지는 이론적 비용량이 매우 높아 연구자와 이차 전지 시장의 많은 관심을 받고 있다.현재 이 두 배터리는 여전히 많은 과학적, 기술적 문제에 직면해 있습니다.그들은 배터리 개발의 초기 연구 단계에 있습니다.더 개선해야 할 배터리 양극재의 비용량과 안정성 외에도 배터리 안전성과 같은 핵심 문제도 시급히 해결해야 한다.미래에 이 두 가지 새로운 유형의 배터리는 더 넓은 응용 가능성을 열기 위해 결함을 제거하기 위해 여전히 지속적인 기술 개선이 필요합니다.
게시 시간: 2023년 4월 7일